Ethvert fremmedstof, som optages i tarmen og kommer ud i blodkredsløbet, bliver ’angrebet’ af kroppens enzymer og andre rengørings-funktioner. Enzymerne er i tidernes morgen udviklet, så vi havde mulighed for at overleve, selvom vi spiste noget, som var skadeligt eller fik en infektion, som udviklede skadelige stoffer. Enzymerne klipper de skadelige stoffer i stykker, så de bliver uskadelige.
Heldigvis er mange af de fremmedstoffer, vi nu indtager, medicin. Medicinen afprøves og testes inden den slippes løs til behandling, så vi kan være rimeligt sikre på, at det ikke går helt galt.
Ganske få enzymer (CYP3A4 og 5, CYP2D6 og CYP2C8 og 9) nedbryder langt de fleste mediciner, som lægerne tilbyder os som anfaldsmedicin. Heldigvis er det også nogenlunde dem, der findes i størst mængder i leveren.
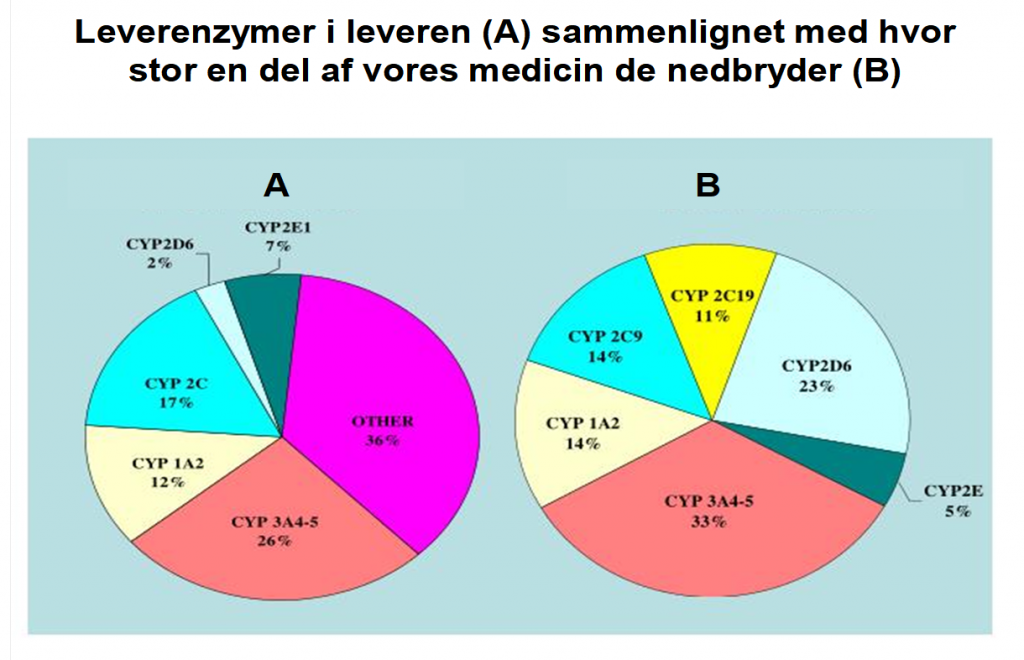
En del medicin går desuden lige igennem til nyrerne og sendes uforandrede ud i toilettet.
Jo længere et fremmedstof forbliver i kroppen, jo mere mærker vi til det. Med længere tid i kroppen, bliver virkningen voldsommere – ligesom bivirkningerne bliver det. Så medicinalproducenterne leder efter en gylden middelvej, hvor medicinen er længe nok i kroppen til at få den ønskede virkning, og samtidig ikke laver for mange bivirkninger.
Men den gyldne middelvej passer kun til de mennesker, som er nogenlunde som gennemsnitttet. Vores evne til at danne enzymer varierer voldsomt fra person til person. For hvert enkelt af lever-enzymerne, som nedbryder medicin (og andre fremmedstoffer), er der en lille gruppe, som nedbryder medicinen hurtigt (ultra hurtige nedbrydere, ultra rapid metabolizers), nogle som er noget hurtigere end gennemsnittet (rapid metabolizers), en stor gennemsnitlig normal gruppe, en ret stor gruppe, som er ’internediate’ (midtimellem) nedbrydere. Og så en mindre gruppe, som er langsomme eller dårlige nedbrydere (poor metabolizers).
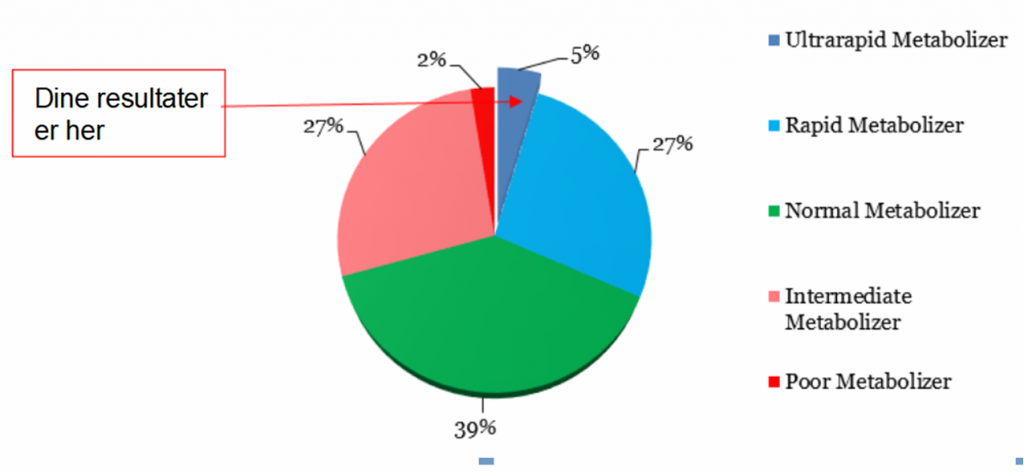
Lignende figurer findes for de fleste mediciner. Det generelle princip er, at de fleste mennesker er hurtige, normale eller intermediate nedbrydere (de 3 store lagkagestykker). De normale nedbrydere får god virkning af medicinen. De hurtige og intermediate nedbrydere får en del bivirkninger og en knapt så god effekt. De to små grupper, de ultra hurtige og de langsomme/dårlige nedbrydere, har derimod mange problemer, enten i form af manglende virkning eller mange bivirkninger. De to grupper med problemer udgør i størrelsesordenen 10 – 30% af befolkningen, hvis vi ser på mange leverenzymer.
Medicinen laves så flest mulige brugere får en god oplevelse, dvs. en god virkning, og ikke for mange bivirkninger. Men de, som er langsomme nedbrydere vil nok kun huske bivirkningerne, selvom virkningen faktisk var god. Og de hurtige nedbrydere vil ikke få nogen virkning – og heller ikke nogen særlige bivirkninger.
Man kan, for nogle mediciner, finde vejledninger, som antyder, at visse brugere har det bedst med nedsatte doser. Men det er desværre ikke let at finde denne slags oplysninger.
Triptanerne nedbrydes stort set af leverenzymer
Vores 7 triptaner nedbrydes af enzymerne CYP1A2, 2D6, 3A4 og MAO-A.
Naratriptan nedbrydes dog slet ikke, men udskilles via nyrerne.
| Triptan | Halveringstid, timer | Nedbrydes af (enzymer) |
| Almotriptan | 3,5 | CYP2D6, CYP3A4, MAO-A |
| Eletriptan | 5 | CYP3A4 |
| Frovatriptan | 25 | CYP1A2, CYP2D6 |
| Naratriptan | 6 | Udskilles via nyrerne |
| Rizatriptan | 2 | CYP1A2, MAO-A |
| Sumatriptan | 2 – 2,5 | MAO-A |
| Zolmitriptan | 2,5 – 3 | CYP1A2, CYP3A4, MAO-A |
Halveringstiderne afgør, hvor meget medicin vi har i kroppen, i timerne efter vi har taget medicinen.
Frovatriptan har den længste halveringstid blandt triptanerne (25 timer). Tre doser Frovatriptan med 25 timers mellemrum akkumuleres til næsten det dobbelte af en enkelt dosis i løbet af 3 doser (den blå kurve), mens en dosis Sumatriptan (med en halveringstid på ca. 2 timer – den grønne kurve) stort set er nedbrudt på et døgn, og derfor ikke akkumuleres, hvis man tager en dosis i døgnet.
Man regner som tommelfingerregel med, at efter 5 halveringstider er mængden af medicin i kroppen så lille, at den ikke har betydning.

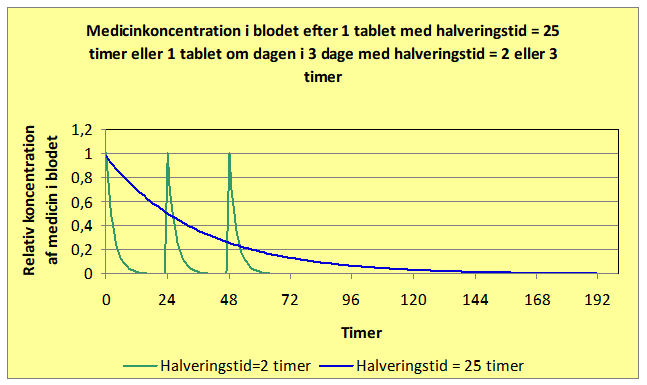
I begge figurer er y-aksen (den lodrette) gjort relativ, dvs. vi antager at alt det aktive stof i en pille straks optages i blodet, og at denne koncentration er lig med 1. Så kan vi let sammenligne, hvad der sker på grund af de forskellige halveringstider.
Eletriptan nedbrydes ’kun’ af enzymet CYP3A4. Her er det derfor klart, at en migræniker, som ikke får nogen virkning eller bivirkning af Eletriptan, må have et CYP3A4-enzym, som arbejder ultrahurtigt. Så vil Almotriptan og Zolmitriptan nok heller ikke virke optimalt, for de nedbrydes også ultrahurtigt af CYP3A4. Desværre ved vi ikke, hvilket af enzymerne, som fortrinsvis nedbryder medicinen, så denne slags forudsigelser er endnu ikke dokumenterede.
Giver Eletriptan mange bivirkninger (fordi CYP3A4 nedbryder medicinen meget langsomt) vil der nok også komme bivirkninger af Almotriptan og Zolmitriptan. Man som sagt ovenfor, kender vi ikke samspillet er mellem to eller flere enzymer, som nedbryder triptanerne.
Derfor er disse forudsigelser behæftet med en vis usikkerhed. Er CYP3A4 langsomt, kan MAO-A og CYP2D6 måske overtage opgaven og få Almotriptan nedbrudt, inden der opstår alvorlige bivirkninger.
Er man langsom nedbryder af CYP1A2, vil Frovatriptan kunne nedbrydes af CYP2D6, ligesomZolmitriptan vil kunne nedbrydes af MAO-A og CYP3A4.
MAO – et helt specielt enzym
Den genetiske basis for MAO-A og MAO-B sidder i X-kromosomet. Så mænd har én udgave af disse gener, mens kvinder, som har to X-kromosomer, har to sæt.
MAO er et enzym, som også nedbryder Sumatriptan, Almotriptan, Zolmitriptan og Rizatriptan. Desuden nedbryder MAO også tyramin og phenylethylamin. Tyramin og phenylethylamin findes i en del fødevarer, f.eks. stærk ost og chokolade, og kan udløse migræneanfald, hvis vi ikke nedbryder tyraminen hurtigt. MAO findes i to udgaver: MAO-A og MAO-B. MAO-A findes især i tarmen, mens MAO-B især findes i hjernen.
MAO-A og MAO-B er naboer på X-kromosomet. MAO-A-genet kommer i en stribe varianter (afbildet under X-kromosomet i figuren).
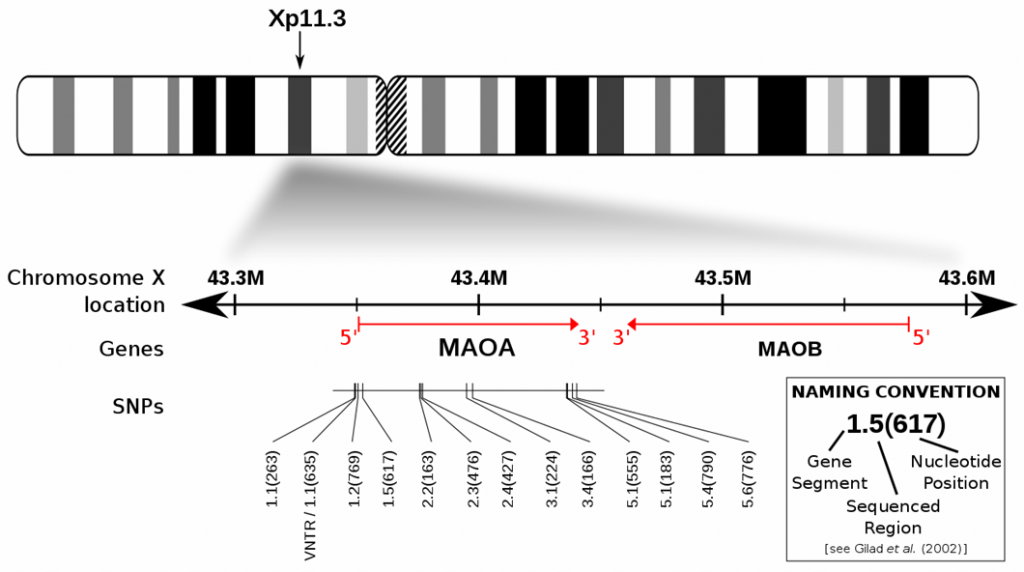
I kromosom-figuren ses det, at aktiviteten af enzymet MAO-A bestemmes af det segment på kromosomet, som hedder Xp11.3. Indholdet i segmentet er vist nedenfor kromosomet (ligner et party-telt). VNTR kaldes en promotor, dvs. det er den del af genet, som afgør, hvilke dele der er aktive. Med normal MAO-A aktivitet nedbryder enzymet MAO-A foruden vores triptaner også passende mængder af serotonin og norepinephrin.
MAO-A genet har 12 varianter og en promotor (’teltstængerne’ på figuren). Det giver basis for mange varianter for, hvor aktivt enzymet MAO-A er. Hver variant er en lidt redigeret kopi af den oprindelige lille DNA-streng i genet, og tilsammen gør de mange varianter, at den samlede effekt på nedbrydningen af tyramin i kroppen er forholdsvis beskeden. Der er altid en variant, som kan overtage opgaven.
MAO-A i kroppen holder nogenlunde trit med mængden af tyramin i blodet, uanset om der er en stor eller lille tilførsel af tyramin.
Kroppens vigtigste bolværk mod tyramin findes i tyndtarmen. Her er der hos de fleste rigeligt med MAO-A, som i den levende tarm nedbryder tyraminen inden den optages i blodet.
Tyramin i blodet nedbrydes af leverenzymet CYP2D6 og af MAO-A. En undersøgelse fra 2019 viste, at der er meget lille variation mellem mennesker på, hvor effektivt CYP2D6 nedbryder tyramin i blodet . CYP2D6 har et stort antal varianter og dubleringer af det gen, som producerer enzymet, og det anses for at være forklaringen på, at der ikke kan findes personer, hvis CYP2D6 gør dem til langsomme eller hurtige nedbrydere.
Ikke desto mindre er det erfaringen blandt migrænikere, at en del migrænikere får et anfald, hvis de spiser noget med højt tyramin- eller phenylethylamin-indhold.
En braziliansk undersøgelse fra 2021 viste, at der er en del tyramin og phenylethylamin i chokolade (70% kakao), og at indholdet af begge biogene aminer stiger væsentligt, hvis chokoladen udsættes for en fordøjelse in vitro (dvs. i reagensglas), med de naturlige fordøjelsesenzymer. Det konkluderes derfor implicit, at der sker en fermentering af chokoladen på vej gennem fordøjelseskanalen, og at der kan dannes store mængder tyramin, mens chokoladen bevæger sig gennem tarmsystemet.
Men vi ved (nogle af os af bitter erfaring), at en række antidepressive mediciner og medicin mod Alzheimers og Parkinsons sygdomme er MAO-A-hæmmere. Hvis man tager en medicin, som er en MAO-inhibitor, bør man få en kostvejledning fra lægen. Hvis MAO-enzymet blokeres af en medicin, vil fødevarer med tyramin og/eller phenylethylamin udløse højt blodtryk og migræne.

Der ser ud til at være enighed om, at 70% af MAO-A-aktiviteten, og dermed nedbrydningen af tyramin, sker i tarmen. Resten sker rundt om i kroppens organer. Hvis den første nedbrydning (de 70%) i tarmen forhindres, f.eks. ved brug af medicin mod Alzheimers eller Parkinson’s, optager tarmen væsentligt mere tyramin end normalt. Det kan føre til ’kinesermad-syndrom’, idet mange af de ’kinesiske’ retter, vi får på restauranter og take aways, indeholder store mængder smagsforstærker, som hovedsageligt består af tyramin. Det giver pludselig stigning i blodtrykket, og dette forstærkes og kan blive livstruende, hvis man er i behandling med en medicin, som er en MAO-hæmmer. Ved mindre doser tyramin udløses der ’bare’ et migræneanfald.
Hvis du får tilbudt behandling med en MAO-hæmmer, er det godt at få en grundig snak med lægen om din kost.
En gentest ville være langt mindre smertefyldt end at prøvespise stærke oste, for at prøve om de udløser migræne. Men jeg er ikke sikker på lødigheden af de gentests, der er på markedet for MAO-hæmning.
Nogle migrænikere lever hele livet med en reaktion på tyraminholdige fødevarer. En selv-test, hvis du ikke er laktose-intolerant, er f.eks. at købe tre (små) stykker stærk ost. Spis max 100 g af den ene på en dag uden migræne. Skriv dagbog. Efter en uges tid spiser du af den næste ost. Skriv dagbog. Og efter endnu en uge, smager du på den tredje stærke ost. Med tre migræneanfald, udløst af de tre oste, er det ret sikkert, at du får migræne af tyramin (eller at du er laktose-intolerant).
Producenterne af Sumatriptan, Zolmitriptan, Rizatriptan og Almotriptan (som alle nedbrydes af MAO-A) angiver halveringstider for disse mediciner på mellem 2 og 3½ time. Vi ved ikke, i hvilken grad det afspejler aktiviteten af MAO eller de andre enzymer, som nedbryder disse medici.
CGRP antistoffer
Her er vi ovre i et helt andet system end lever-enzymerne, som er beskrevet ovenfor. Aimovig nedbrydes fortrinsvis via det, som producenterne kalder “a non-specific proteolytic pathway with the effective half-life of 28 days”. Det defineres ikke yderligere, men ordet proteolyse betyder nedbrydning af proteiner. De skriver også, at nedbrydningen ikke påvirkes af eventuelle problemer i lever eller nyrer.

Det tager 4 – 6 dage efter injektionen , før medicinen har fundet vej ud i kroppen og virkningen er stærkest. Så virkningen burde komme efter en uges tid.
CGRP-antistofferne gives jo som månedlige injektioner. Nogle læger mener, det er bedst at starte med en booster – dvs. en dobbelt dosis. Andre begynder med den dosis, som også bruges de følgende måneder. Jeg har beregnet hvor meget medicin der er i kroppen (i procent af den normale dosis) efter 1, 2, 3 osv. måneder. Det viser sig at forskellen mellem at få en booster eller ej, udjævnes i løbet af de første ca. 2 måneder. Den røde kurve i figuren dækkes af den blå farve efter de første måneder.
Og så er der noget der kaldes SLCO eller OATS – hvad er det så?
Lever-enzymerne (dem der har et navn der begynder med CYP) findes specielt i leverceller. Så fremmedstoffer i blodet (f.eks. medicin) som nedbrydes af leverenzymerne, skal ind i levercellerne, for at blive nedbrudt. Vejen ind i en celle går via en receptor. Det er den, der kaldes SLCO eller OATS. Tænk på den som en lille dør, som kan være mere eller mindre åben – eller helt lukket – alt afhængigt af, hvilket stof der prøver at komme ind. Der er selvfølgelig mange receptorer på hver celle, men de åbner og lukker principielt på same måde alle sammen.
Ligesom vi har forskelle i enzym-aktiviteterne bestemt af vores gener, er disse ’døres’ åbning genbestemt. Nogle af os (de fleste) åbner dørene og lader medicinen ind i levercellerne, men et mindretal lukker kun en smule op, eller stort set slet ikke.
Tilhører man denne gruppe mennesker, dem med stort set lukkede SLCO-døre i levercellerne, vil medicin, som nedbrydes af lever-enzymerne give mange bivirkninger, men også en fantastisk virkning.
Tilhører man gruppen, som har leverceller, som har lukkede SLCO-døre overfor triptanernes lever-enzymer, vil de triptaner, der nedbrydes af MAO nok virke bedst, mens f.eks. Eletriptan og Frovatriptan, som kun nedbrydes af leverenzymer, vil give bivirkninger. Dette er ikke undersøgt, ’kun’ en logisk slutning ud fra det, vi ved, om triptanerne og levercellernes receptorer.
Vi ved heller ikke om CGRP-antistofferne et sted undervejs i nedbrydningen (proteolysen, som fagfolk kalder det) kommer til en lukket dør i en levercelle eller et andet sted i processen.
Hvad har vi lært?
Nedbrydningen af medicin er mindst lige så vigtig som virkningen. De mennesker, som tilhører grupperne af ultra hurtige nedbrydere og langsomme nedbrydere af leverenzymerne (dem der har navne der begynder med CYP) får helt andre virkninger/bivirkninger end de mere gennemsnitlige personer. Og bivirkningerne kan være alvorlige. Også dem, der har leverceller, som ikke optager medicinen, vil få super effekt og masser af bivirkninger.
Vi ved ikke nok om MAO (monoaminoksidase) og variationen i nedbrydningen. Men vi ved at medicinen som rutinemæssigt tilbydes til Parkinson og Alzheimer-patienter kan blokere MAO-A og/eller MAO-B. Det kan føre til i værste fald fatale konsekvenser, hvis den intetanende patient deltager i en fest med ost og rødvin, eller snupper en kinesisk take-away. Begge aktiviteter er noget de fleste af os gør af og til.
