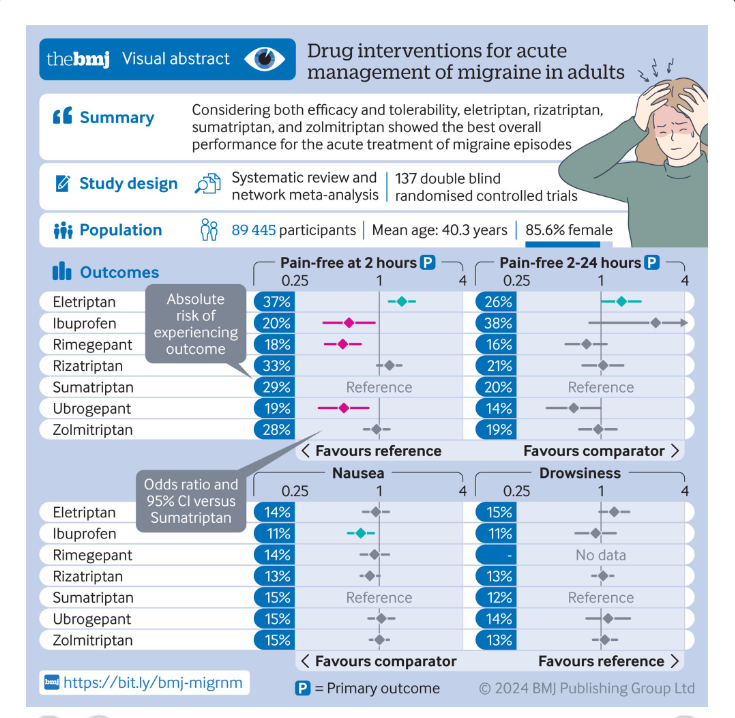
Vi får stribevis af ikke-helt-ærlige reklamer (evt. forklædt som forskningsresultater) om migrænemedicin. Og de får lov at ‘leve’ på internettet, så rigtigt mange ser dem.
Nu har FDA (USA’s lægemiddelstyrelse) reageret på en reklame, som påstår at gepanten Ubrelvy virker hurtigt og at en dosis fjerner migrænesmerterne.
Når så en sportstjerne som Serena Williams er afsenderen af budskabet, bliver det ekstra troværdigt.

Nej, siger FDA, Ubrelvy lindrer migrænesmerterne hos hver femte migræniker indenfor 2 timer. Så Ubrelvy virker ikke hurtigt (ikke hurtigere end tilsvarende midler) og en dosis virker kun på et mindredtal af brugerne.
FDA havde, inden reklamen blev publiceret, advaret firmaet AbbVie, som markedsfører Ubrelvy, om at reklamen ikke var acceptabel.
Er det en enlig svale?
Jeg har ikke set lignende situationer tidligere. Men jeg ser masser af publikationer, som indeholder lige så misvisende informationer om medicin. Se f.eks. blogindlæget om “Hvor effektive er CGRP antistofferne virkelig?”
En reklame med en kendis i front læses givetvis af flere letpåvirkelige migrænikere end en støvet forskningsrapport. Men på langt sigt er det nok forskningsresultaterne (også de knapt så ærlige), som har en blivende effekt.
Så jeg krydser fingre for, at FDA (og andre landes lægemiddelstyrelser) tager udfordringen op og rydder op i misinformationer, både i reklamerne for medicin og i information fra forskerne til læger og andre behandlere, så vi (patienterne/kunderne) får forventninger til vores medicin, som nogenlunde svarer til det, vi oplever, når vi tager medicinen.
Lyv ikke i reklamerne/forskningsresultaterne
Grundlæggende, må man ikke lyve i en reklame. Det er vist en generelt accepteret regel verden over. Men der er mange grå-toner mellem en 100% ærlig information og information, som får kunderne til at synes godt om produktet. Efter min mening er det klart misinformation, når en videnskabelig publikation som den, jeg omtalte i blogindlægget “Hvor effektive er CGRP antistofferne virkelig?”, beregner procentdelen af de tilfredse forsøgsdeltagere ud fra den gruppe, som ikke har opgivet behandlingen. Man bør/skal selvfølgelig beregne resultaterne ud fra den oprindelige gruppe deltagere. Det er logik, etik og god kommunikation for begyndere.
Så der er rigtigt meget at tage fat på for diverse lægemiddelstyrelser verden over.
Hvad får vi ud af al den ærlighed?
På sigt vil en sådan oprydning i informationsstrømmen gavne patienterne (som får realistiske forventninger til deres behandling), sundhedsbudgetterne (som kan nøjes med at betale for medicin, som har en rimelig virkning), og reducere bivirkningerne fra medicinsk behandling, som reelt ikke virker.
Det må da være en win-win-situation – også for medicinalfirmaerne, som med tiden vil opnå et ry som troværdige.
Så alle verdens lægemiddelstyrelser, se nu at komme igang – NU!